CAMBRIDGE, Mass .-- ( BUSINESS WIRE ) - A US Food and Drug Administration (FDA) aprovou da Biogen (NASDAQ: BIIB) SPINRAZA ™
(nusinersen) sob Exame Prioritário para o tratamento da atrofia muscular espinhal (AME) em pediátricos e adultos pacientes. SPINRAZA é o primeiro e único tratamento aprovado nos Estados Unidos para a SMA, uma das principais causas genéticas de morte em lactentes e crianças que é marcado por fraqueza muscular progressiva e debilitante.
Em ENDEAR, um estudo clínico controlado pivotal, os pacientes SMA de início infantil tratados com SPINRAZA alcançaram e mantiveram melhora clinicamente significativa na função motora em comparação com os participantes do estudo não tratados. Além disso, uma maior porcentagem de pacientes em SPINRAZA sobreviveu em comparação com pacientes não tratados. Em estudos abertos, alguns pacientes alcançaram marcos como a capacidade de sentar-se sem ajuda, ficar de pé ou andar quando de outra forma seria inesperado fazê-lo e mantiveram marcos em idades em que se esperava que estivessem perdidos. Os resultados globais destes estudos suportam a eficácia de SPINRAZA em toda a gama de doentes com SMA e parecem apoiar o início precoce do tratamento.
" SPINRAZA oferece uma nova esperança para a comunidade SMA e exemplifica nossa missão de aplicar ciência de ponta para fazer uma diferença significativa nas vidas de pacientes com doenças devastadoras, que mudam a vida", disse George A. Scangos, Ph.D., chefe Executivo da Biogen. " Estamos humilhado e grato pelo empenho dos pacientes e famílias que participaram do programa de ensaios clínicos SPINRAZA, os esforços incansáveis de nossos investigadores, e a urgência demonstrada pela FDA em rever e aprovar este tratamento rapidamente. Nós também queremos reconhecer o importante trabalho de nossos colegas em Ionis, que iniciou este programa. "
A aprovação FDA do SPINRAZA foi baseada em resultados positivos de múltiplos estudos clínicos em mais de 170 pacientes. O pacote de dados incluiu a análise interina de ENDEAR, um estudo controlado de Fase 3 avaliando SPINRAZA em início infantil, bem como dados abertos em pacientes pré-sintomáticos e sintomáticos com, ou susceptíveis de desenvolver, SMA de Tipos 1, 2 e 3 .
" Com a aprovação hoje de SPINRAZA, o futuro para as pessoas afectadas com SMA mudou. Estamos especialmente satisfeitos que este sofisticado e rigoroso plano de desenvolvimento clínico resultou em uma ampla etiqueta que pode oferecer acesso a muitos pacientes ", disse Kenneth Hobby, presidente da Cure SMA. " Esta tem sido uma história de todos os grupos - famílias, pesquisadores, empresas e do FDA - a trabalhar juntos como uma comunidade."
SPINRAZA estará disponível para envio nos EUA para os provedores de cuidados de saúde em aproximadamente uma semana. Biogen antecipa que pode haver variação no tempo de tratamento como instituições e centros de tratamento aprender sobre SPINRAZA.
O SPINRAZA Fase 3 registrational Study, encarecer
encarecer foi um estudo duplo-cego controlado por sham randomizado, em pacientes com infantile-início (mais susceptíveis de desenvolver Tipo 1) SMA. Em uma análise provisória planejada de ENDEAR, uma porcentagem maior de lactentes tratados com SPINRAZA obteve uma resposta milestone motor em comparação com aqueles que não receberam tratamento (40% versus 0%, p <0 a="" al="" analisados="" cia="" com="" compara="" conforme="" consistentemente="" dados="" de="" disso="" dos="" efic="" em="" examination="" favor="" foram="" hammersmith="" infant="" lactentes="" m="" medido="" menor="" metros="" morreu="" n="" neurological="" o="" os="" outros="" p="" pacientes="" par="" pelo="" porcentagem="" que="" receberam="" spinraza="" tratados="" tratamento.="" uma="">
encarecer foi um estudo duplo-cego controlado por sham randomizado, em pacientes com infantile-início (mais susceptíveis de desenvolver Tipo 1) SMA. Em uma análise provisória planejada de ENDEAR, uma porcentagem maior de lactentes tratados com SPINRAZA obteve uma resposta milestone motor em comparação com aqueles que não receberam tratamento (40% versus 0%, p <0 a="" al="" analisados="" cia="" com="" compara="" conforme="" consistentemente="" dados="" de="" disso="" dos="" efic="" em="" examination="" favor="" foram="" hammersmith="" infant="" lactentes="" m="" medido="" menor="" metros="" morreu="" n="" neurological="" o="" os="" outros="" p="" pacientes="" par="" pelo="" porcentagem="" que="" receberam="" spinraza="" tratados="" tratamento.="" uma="">
Os resultados provisórios detalhados da ENDEAR serão apresentados na Conferência Anual da British Pediatric Neurology Association (BPNA) em janeiro de 2017.
Programa SPINRAZA Updates
Biogen licenciou os direitos globais para desenvolver, fabricar e comercializar SPINRAZA de Ionis Pharmaceuticals (Nasdaq: IONS), líder em terapêutica anti-sentido. Biogen e Ionis conduziram um inovador programa de desenvolvimento clínico que deslocou SPINRAZA de sua primeira dose em seres humanos em 2011 para sua primeira aprovação regulamentar em cinco anos. Com base na aprovação FDA do SPINRAZA, Ionis receberá um pagamento marco de US $ 60 milhões. Ionis também é elegível para receber royalties escalonados em todas as vendas potenciais de SPINRAZA até uma porcentagem no mid-teens.
Biogen licenciou os direitos globais para desenvolver, fabricar e comercializar SPINRAZA de Ionis Pharmaceuticals (Nasdaq: IONS), líder em terapêutica anti-sentido. Biogen e Ionis conduziram um inovador programa de desenvolvimento clínico que deslocou SPINRAZA de sua primeira dose em seres humanos em 2011 para sua primeira aprovação regulamentar em cinco anos. Com base na aprovação FDA do SPINRAZA, Ionis receberá um pagamento marco de US $ 60 milhões. Ionis também é elegível para receber royalties escalonados em todas as vendas potenciais de SPINRAZA até uma porcentagem no mid-teens.
Em Outubro, a Agência Europeia de Medicamentos (EMA) validou o pedido de Autorização de Introdução no Mercado (AMA) da Biogen para a SPINRAZA como tratamento para a SMA eo Comité dos Medicamentos para Uso Humano (CHMP) da EMA obteve o estatuto de Avaliação Acelerada. Além disso, a Biogen apresentou arquivamentos regulatórios no Japão, Canadá e Austrália e iniciará registros adicionais em outros países em 2017.
A FDA emitiu Biogen um voucher de revisão prioritária de doenças pediátricas raras com a aprovação do SPINRAZA, que confere prioridade revisão para uma aplicação de droga subsequente que não seria qualificado para revisão prioritária. O programa de revisão de doenças pediátricas raras é concebido para encorajar o desenvolvimento de novos fármacos e produtos biológicos para a prevenção ou tratamento de doenças raras pediátricas.
Para mais informações sobre SPINRAZA e US prescrição informações, visite www.SPINRAZA.com .
Sobre Apoio ao Paciente
Como parte do compromisso da Biogen para os pacientes e famílias que vivem com SMA, a empresa lançou SMA360 ° ™, que fornece determinados serviços que tratam de barreiras não-médicos para o acesso nos Estados Unidos. Estes incluem assistência logística, educação de produtos, investigações de benefícios de seguros e assistência financeira. Uma lista das ofertas SMA360 ° estará disponível nos próximos dias no www.SPINRAZA.com .
Como parte do compromisso da Biogen para os pacientes e famílias que vivem com SMA, a empresa lançou SMA360 ° ™, que fornece determinados serviços que tratam de barreiras não-médicos para o acesso nos Estados Unidos. Estes incluem assistência logística, educação de produtos, investigações de benefícios de seguros e assistência financeira. Uma lista das ofertas SMA360 ° estará disponível nos próximos dias no www.SPINRAZA.com .
Os serviços SMA360 ° da Biogen estão disponíveis apenas para aqueles que foram prescritos SPINRAZA. Para saber mais sobre o programa e receber informações adicionais sobre esses serviços, entre em contato com um Coordenador de Suporte da SMA no 1-844-4SPINRAZA (1-844-477-4672) de segunda a sexta-feira das 8:30 am às 8:00 pm EST.
Sobre SMA 05/01
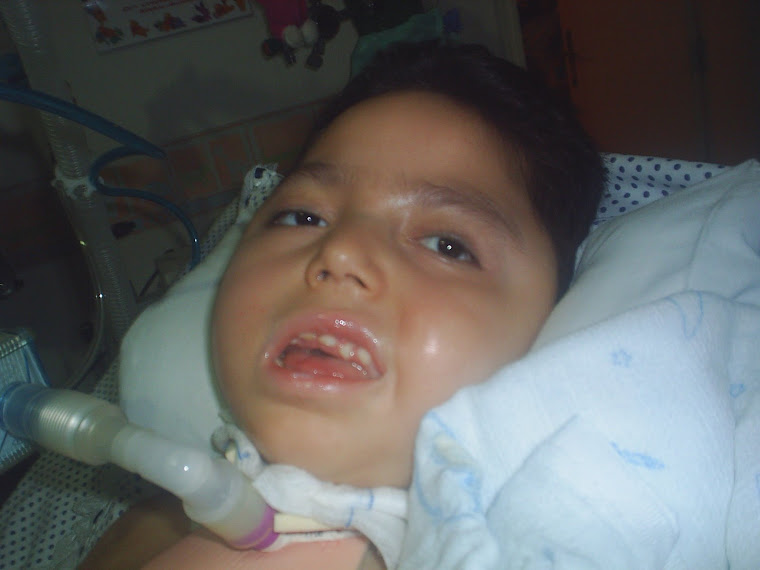
atrofia muscular espinal (SMA) é caracterizada por perda de neurónios motores na espinal medula e tronco cerebral inferior, resultando na atrofia muscular progressiva e severa e fraqueza. Em última análise, os indivíduos com o tipo mais grave de SMA pode ficar paralisado e ter dificuldade em desempenhar as funções básicas da vida, como respirar e engolir.
atrofia muscular espinal (SMA) é caracterizada por perda de neurónios motores na espinal medula e tronco cerebral inferior, resultando na atrofia muscular progressiva e severa e fraqueza. Em última análise, os indivíduos com o tipo mais grave de SMA pode ficar paralisado e ter dificuldade em desempenhar as funções básicas da vida, como respirar e engolir.
Devido a uma perda ou defeito no gene SMN1, as pessoas com SMA não produzem proteína de neurônio motor de sobrevivência (SMN) suficiente, o que é crítico para a manutenção dos neurónios motores. A gravidade da SMA correlaciona-se com a quantidade de proteína SMN. As pessoas com SMA Tipo 1, a forma mais grave de risco de vida, produzem muito pouca proteína SMN e não conseguem a capacidade de sentar-se sem apoio ou viver além de dois anos sem suporte respiratório. As pessoas com SMA Tipo 2 e Tipo 3 produzem maiores quantidades de proteína SMN e têm formas menos graves, mas ainda alterando a vida da SMA.
Para apoiar a conscientização e educação sobre a SMA, a Biogen lançou a Together in SMA nos Estados Unidos. Juntos na SMA é um programa criado para fornecer materiais informativos e recursos para a comunidade SMA. Saiba mais em www.TogetherinSMA.com .
Sobre SPINRAZA ™ (nusinersen)
SPINRAZA está a ser desenvolvida a nível mundial para o tratamento da SMA.
SPINRAZA está a ser desenvolvida a nível mundial para o tratamento da SMA.
SPINRAZA é um oligonucleótido anti-sentido (ASO) que é projetado para tratar SMA causado por mutações no cromossomo 5q que leva à deficiência de proteína SMN. SPINRAZA altera o splicing de SMN2 pre-mRNA, a fim de aumentar a produção de comprimento total proteína SMN. 6 ASOs são sequências sintéticas curtas de nucleótidos concebidos para se ligarem selectivamente ao RNA alvo e regular a expressão do gene. Através do uso desta tecnologia, SPINRAZA tem o potencial de aumentar a quantidade de proteína SMN de comprimento total em pacientes com SMA.
SPINRAZA é administrado através de injeção intratecal, que oferece terapias diretamente para o líquido cefalorraquidiano (LCR) em torno da medula espinhal, 7 , onde os neurônios motores degeneram em pacientes com SMA devido aos níveis insuficientes de proteína SMN. 8
As reações adversas mais comuns relatadas para SPINRAZA foram infecção respiratória superior, infecção respiratória inferior e constipação. Reações adversas graves de atelectasia foram mais freqüentes em pacientes tratados com SPINRAZA. Anomalias de coagulação e trombocitopenia, incluindo trombocitopenia grave aguda, foram observadas após a administração de alguns oligonucleótidos anti-sentido. A toxicidade renal, incluindo a glomerulonefrite potencialmente fatal, foi observada após a administração de alguns oligonucleótidos anti-sentido.
Para obter informações completas SPINRAZA prescrição visite www.SPINRAZA.com .
Sobre a Biogen
Através da ciência de ponta e medicina, Biogen descobre, desenvolve e oferece terapias inovadoras em todo o mundo para as pessoas que vivem com neurológica grave, doenças autoimunes e doenças raras. Fundada em 1978, a Biogen é uma das empresas de biotecnologia independentes mais antigas do mundo e pacientes em todo o mundo beneficiam-se da sua principal esclerose múltipla e terapias inovadoras para a hemofilia. Para mais informações, visite www.biogen.com . Siga-nos no Twitter .
Através da ciência de ponta e medicina, Biogen descobre, desenvolve e oferece terapias inovadoras em todo o mundo para as pessoas que vivem com neurológica grave, doenças autoimunes e doenças raras. Fundada em 1978, a Biogen é uma das empresas de biotecnologia independentes mais antigas do mundo e pacientes em todo o mundo beneficiam-se da sua principal esclerose múltipla e terapias inovadoras para a hemofilia. Para mais informações, visite www.biogen.com . Siga-nos no Twitter .
Biogen Safe Harbor
Este comunicado de imprensa contém declarações prospectivas, incluindo declarações relativas ao potencial de segurança e eficácia de SPINRAZA, registros e aprovações normativos em outras jurisdições, e planejamento e tempo para o lançamento comercial. Essas declarações podem ser identificadas por palavras como "acreditar", "exceto", "pode", "planejar", "potencial", "vontade" e expressões semelhantes e baseiam-se em nossas crenças e expectativas atuais. Você não deve depositar confiança indevida nessas declarações. Essas declarações envolvem riscos e incertezas que podem fazer com que os resultados reais diferem materialmente daqueles refletidos nessas declarações, incluindo a incerteza de sucesso na comercialização do SPINRAZA, que pode ser impactada, entre outras coisas, pelo nível de prontidão dos profissionais de saúde no tratamento de pacientes , Dificuldades na obtenção ou alteração da disponibilidade de reembolso para SPINRAZA, efetividade de vendas e esforços de marketing, problemas com o processo de fabricação da SPINRAZA, ocorrência de eventos adversos de segurança, não obtenção de aprovações regulatórias em outras jurisdições, Propriedade e outros direitos de propriedade, reivindicações de responsabilidade do produto, riscos de colaboração de terceiros e os outros riscos e incertezas que são descritos na seção Fatores de Risco do último relatório anual ou trimestral da Biogen e em outros relatórios que a Biogen entrou com a US Securities and Exchange Comissão (SEC). Todas as declarações prospectivas falam apenas a partir da data deste comunicado de imprensa e não assumimos qualquer obrigação de atualizar qualquer declaração prospectiva.
Este comunicado de imprensa contém declarações prospectivas, incluindo declarações relativas ao potencial de segurança e eficácia de SPINRAZA, registros e aprovações normativos em outras jurisdições, e planejamento e tempo para o lançamento comercial. Essas declarações podem ser identificadas por palavras como "acreditar", "exceto", "pode", "planejar", "potencial", "vontade" e expressões semelhantes e baseiam-se em nossas crenças e expectativas atuais. Você não deve depositar confiança indevida nessas declarações. Essas declarações envolvem riscos e incertezas que podem fazer com que os resultados reais diferem materialmente daqueles refletidos nessas declarações, incluindo a incerteza de sucesso na comercialização do SPINRAZA, que pode ser impactada, entre outras coisas, pelo nível de prontidão dos profissionais de saúde no tratamento de pacientes , Dificuldades na obtenção ou alteração da disponibilidade de reembolso para SPINRAZA, efetividade de vendas e esforços de marketing, problemas com o processo de fabricação da SPINRAZA, ocorrência de eventos adversos de segurança, não obtenção de aprovações regulatórias em outras jurisdições, Propriedade e outros direitos de propriedade, reivindicações de responsabilidade do produto, riscos de colaboração de terceiros e os outros riscos e incertezas que são descritos na seção Fatores de Risco do último relatório anual ou trimestral da Biogen e em outros relatórios que a Biogen entrou com a US Securities and Exchange Comissão (SEC). Todas as declarações prospectivas falam apenas a partir da data deste comunicado de imprensa e não assumimos qualquer obrigação de atualizar qualquer declaração prospectiva.
Darras B, Markowitz J, Monani U, De Vivo D. Capítulo 8 - Atrofias Musculares Espinhais. In: Vivo BTD, ed. Distúrbios neuromusculares de infância e Adolescência (Second Edition) . San Diego: Academic Press; 2015: 117-145.
Lefebvre S, Burglen L, Reboullet S, et ai. Identificação e caracterização de um gene determinante da atrofia muscular espinhal. Célula. 1995; 80 (1): 155-165.
Mailman MD, Heinz JW, Papp AC, et ai. Análise molecular da atrofia muscular espinhal e modificação do fenótipo por SMN2. Genet Med. 2002; 4 (1): 20-26.
Monani UR, Lorson CL, Parsons DW, et ai. Uma diferença de nucleótidos única que altera padrões de emenda distingue o gene SMA SMN1 do gene de cópia SMN2. Hum Mol Genet. 1999; 8 (7): 1177-1183.
Peeters K, Chamova T, Jordanova A. Diversidade clínica e genética de atrofias musculares espinais proximais SMN1-negativas. Cérebro. 2014; 137 (Pt 11): 2879-2896.
Hua Y, Sahashi K, Hung G, Rigo F, Passini MA, Bennett CF, Krainer AR. A correção antisense do empalhamento de SMN2 no SNC resgata a necrose num modelo de rato SMA de tipo III. Genes Dev. 2010 1 de agosto; 24 (15): 16344-44
Evers MM, Toonen LJ, van Roon-Mãe WM. Oligonucleótidos anti-sentido em terapia para distúrbios neurodegenerativos. Adv Drug Deliv Rev. 2015; 87: 90-103.
Lunn RM, Wang CH. Atrofia muscular espinhal. Lanceta. 2008; 371 (9630): 2120-2133.
Contatos
Biogen
Contato de Mídia:
Ligia Del Bianco, +1 781-464-3260
public.affairs@biogen.com
ou
Investidores:
Ben Strain, +1 781-464-2442
IR@biogen.com
Lefebvre S, Burglen L, Reboullet S, et ai. Identificação e caracterização de um gene determinante da atrofia muscular espinhal. Célula. 1995; 80 (1): 155-165.
Mailman MD, Heinz JW, Papp AC, et ai. Análise molecular da atrofia muscular espinhal e modificação do fenótipo por SMN2. Genet Med. 2002; 4 (1): 20-26.
Monani UR, Lorson CL, Parsons DW, et ai. Uma diferença de nucleótidos única que altera padrões de emenda distingue o gene SMA SMN1 do gene de cópia SMN2. Hum Mol Genet. 1999; 8 (7): 1177-1183.
Peeters K, Chamova T, Jordanova A. Diversidade clínica e genética de atrofias musculares espinais proximais SMN1-negativas. Cérebro. 2014; 137 (Pt 11): 2879-2896.
Hua Y, Sahashi K, Hung G, Rigo F, Passini MA, Bennett CF, Krainer AR. A correção antisense do empalhamento de SMN2 no SNC resgata a necrose num modelo de rato SMA de tipo III. Genes Dev. 2010 1 de agosto; 24 (15): 16344-44
Evers MM, Toonen LJ, van Roon-Mãe WM. Oligonucleótidos anti-sentido em terapia para distúrbios neurodegenerativos. Adv Drug Deliv Rev. 2015; 87: 90-103.
Lunn RM, Wang CH. Atrofia muscular espinhal. Lanceta. 2008; 371 (9630): 2120-2133.
Contatos
Biogen
Contato de Mídia:
Ligia Del Bianco, +1 781-464-3260
public.affairs@biogen.com
ou
Investidores:
Ben Strain, +1 781-464-2442
IR@biogen.com














































































Nenhum comentário:
Postar um comentário